

Tavola Periodica di Mendeleev. Dopo alcuni tentativi di classificare gli elementi fino ad allora noti, indipendentemente tra loro, Mendeleev in Russia e Meyer in Germania scoprirono che, se gli elementi chimici vengono ordinati in base alle loro masse atomiche crescenti, le loro proprietà sono periodiche cioè si ripetono con regolarità.
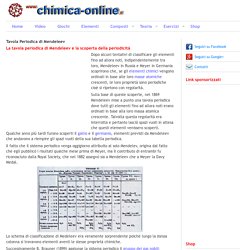
Sulla base di queste scoperte, nel 1869 Mendeleev mise a punto una tavola periodica dove tutti gli elementi fino ad allora noti erano ordinati in base alla loro massa atomica crescente. Talvolta questa regolarità era interrotta e pertanto lasciò spazi vuoti in attesa che questi elementi venissero scoperti. Qualche anno più tardi furono scoperti il gallio e il germanio, elementi previsti da Mendeleev che andavono a riempire gli spazi vuoti della sua tabella periodica. Lo schema di classificazione di Medeleev era veramente sorprendente poichè lungo la stessa colonna si trovavono elementi aventi le stesse proprietà chimiche.
Successivamente B. Nel 1913 G.J. Link sponsorizzati Studia con noi. Gruppo della tavola periodica. Nella tavola periodica degli elementi sono presenti colonne verticali che rappresentano i gruppi della tabella.

I gruppi della tavola periodica hanno una doppia numerazione: la prima in numeri arabi (da 1 a 18), la seconda in numeri romani (da I a VIII). Quest'ultima numerazione, presente solo per i gruppi principali della tavola periodica, indica il numero di elettroni di valenza degli elementi appartenenti a quel gruppo. Gli elementi appartenenti allo stesso gruppo hanno configurazione elettronica esterna dello stesso tipo. Così ad esempio Li, Na, K, hanno tutti configurazione esterna s1: 3Li = 1s2 2s1 11Na = 1s2 2s2 2p6 3s1 19K = 1s2 2s2 2p6 3s2 3p6 4s1 Poichè sono gli elettroni esterni di un atomo quelli che vengono coinvolti nei fenomeni chimici, le proprietà chimiche degli atomi di uno stesso gruppo presentano analogie.
Man mano che si scende lungo un gruppo i valori dell'energia di ionizzazione e dell'elettronegatività diminuiscono. Link sponsorizzati Studia con noi. Strutture di Lewis degli elementi. Gli elettroni di un elemento chimico che partecipano alla formazione dei legami e che determinano la sua reattività, sono gli elettroni più esterni detti elettroni di valenza.
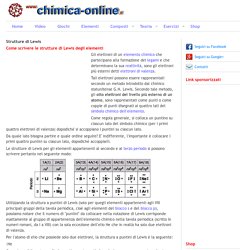
Tali elettroni possono essere rappresentati secondo un metodo introdotto dal chimico statunitense G.N. Lewis. Secondo tale metodo, gli otto elettroni del livello più esterno di un atomo, sono rappresentati come punti o come coppie di punti disegnati ai quattro lati del simbolo chimico dell'elemento. Come regola generale, si colloca un puntino su ciascun lato del simbolo chimico (per i primi quattro elettroni di valenza) dopodichè si accoppiano i puntini su ciascun lato. Da quale lato bisogna partire e quale ordine seguire? Le strutture di Lewis per gli elementi appartenenti al secondo e al terzo periodo si possono scrivere pertanto nel seguente modo: Per l'atomo di elio che possiede solo due elettroni, la struttura a puntini di Lewis è la seguente: :He.
Tavola periodica. Nella moderna tavola periodica degli elementi, a differenza di quanto previsto nella tavola periodica di Mendeleev, gli elementi chimici sono ordinati in base al numero atomico crescente.
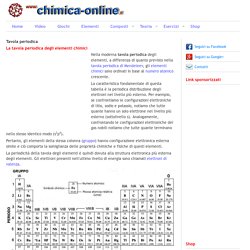
La caratteristica fondamentale di questa tabella è la periodica distribuzione degli elettroni nel livello più esterno. Per esempio, se confrontiamo le configurazioni elettroniche di litio, sodio e potassio, notiamo che tutte quante hanno un solo elettrone nel livello più esterno (sottolivello s). Analogamente, confrontando le configurazioni elettroniche dei gas nobili notiamo che tutte quante terminano nello stesso identico modo (s2p6). Pertanto, gli elementi della stessa colonna (gruppo) hanno configurazione elettronica esterna simile e ciò comporta la somiglianza delle proprietà chimiche e fisiche di questi elementi. La periodicità della tavola degli elementi è quindi dovuta alla struttura elettronica più esterna degli elementi.
Elettroni di valenza. Gli elettroni di valenza di un atomo sono gli elettroni presenti nel suo ultimo livello di energia; sono quelli che patecipano alla formazione dei legami chimici e sono quelli che determinano le proprietà chimiche di un elemento.
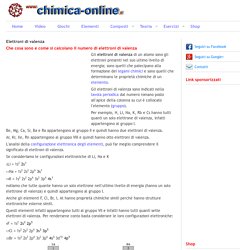
Gli elettroni di valenza sono indicati nella tavola periodica dal numero romano posto all'apice della colonna su cui è collocato l'elemento (gruppo). Per esempio, H, Li, Na, K, Rb e Cs hanno tutti quanti un solo elettrone di valenza, infatti appartengono al gruppo I. Be, Mg, Ca, Sr, Ba e Ra appartengono al gruppo II e quindi hanno due elettroni di valenza. Ar, Kr, Xe, Rn appartengono al gruppo VIII e quindi hanno otto elettroni di valenza. L'analisi della configurazione elettronica degli elementi, può far meglio comprendere il significato di elettroni di valenza. Se consideriamo le configurazioni elettroniche di Li, Na e K 3Li = 1s2 2s1 11Na = 1s2 2s2 2p6 3s1 19K = 1s2 2s2 2p6 3s2 3p6 4s1.