

Millikan's Oil Drop Experiment. [Histoire des sciences] La découverte de l'électron. Modèle atomique de Thompson. Rutherfords Gold Foil Experiment (Discovery of the Atomic Nucleus) 9AE.2 presentation. Rutherford Scattering 1.0.4 Construire un atome 1.2.2. Build an Atom 1.1.2. SK Curriculum. Sciences 9 : RA et indicateurs Analyser l’historique des théories de la structure de la matière jusqu’à et y compris : le modèle de Dalton; le modèle de Thomson; le modèle de Rutherford; le modèle de l’atome de Bohr.

Propose des explications personnelles en ce qui concerne la structure et la composition de la matière. Se sert de la terminologie scientifique pertinente pour décrire les atomes et les éléments (p. ex. masse, charge, électron, proton, neutron, noyau, atome, molécule, élément, composé, neutre, positif, négatif, ion, isotope et tableau périodique). Décrit le point de vue des Premières nations et des Métis sur la nature et la structure de la matière. Détermine les changements majeurs survenus dans notre compréhension de la matière, changements qui ont permis d’expliquer de façon plus détaillée la structure et la composition de l’atome, y compris le modèle de l’atome de Bohr. 4. Sciences 9e - Symboles et formules chimiques. 9. Sciences 9e Tableau périodique.
Modèles atomiques. Sciences 9e Le modèle de Bohr-Rutherford. Histoire de latome. Jeuderole. L'espoir de la découverte d'une nouvelle particule élémentaire s'éteint. En présentant ses plus récents résultats, l'Organisation européenne pour la recherche nucléaire (CERN), qui gère le Grand collisionneur de hadrons, a ainsi annoncé que l'effet repéré dans les analyses de données de 2015 par deux équipes indépendantes ne s'est pas répété dans les données de 2016.
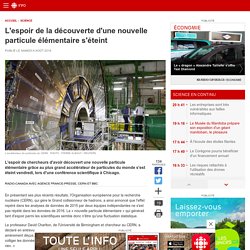
La « nouvelle particule élémentaire » qui générait tant d'espoir parmi les scientifiques semble donc n'être qu'une fluctuation statistique. Le professeur David Charlton, de l'Université de Birmingham et chercheur au CERN, a déclaré en entrevue à la BBC que tous ceux qui travaillaient sur ce projet étaient amèrement déçus. « Il y avait beaucoup d'excitation lorsque nous avons commencé à colliger les données.
Mais dans les derniers résultats, nous n'avons vu aucun signe, il n'y a rien. » « Aujourd'hui, les expériences CMS et ATLAS ont toutes deux rapporté que l'effet prometteur observé [...] dans les données de 2015 avait disparu. L'atome en images. Petit système planétaire ?
Nuages d'électrons autour d'un noyau ? À quoi ressemble véritablement un atome ? En fonction de l'époque ou du contexte scientifique, il peut prendre des formes radicalement différentes. Charlotte Bigg, historienne des sciences au Centre Alexandre Koyré, revient sur les nombreuses représentations de ces grains de matière. Tapez "atome image" dans le champ de recherche de la photothèque du CNRS et vous verrez s’afficher presque autant de styles d’image que de résultats. Illustration n° 1 : Monocristal d'or de 8 nanomètres observé par microscopie électronique à haute résolution. Mais alors que voit-on sur ces images de microscopie électronique ?
Illustration n°2 : Image 3D d'une protéine obtenue par cristallographie des rayons X. Illustration n°3 : Cette figure représente la structure d'un complexe organométallique : Fe(C4H4N2)[Pt(CN)4]. Pourquoi tant d’images différentes ? Niels Bohr : grandes et petites vérités. En 1913, Niels Bohr (1885-1962) proposa une structure pour l’atome qui complétait et améliorait le modèle planétaire imaginé par Rutherford qui était basé sur des principes uniquement classiques qui ne permettaient pas de donner une interprétation satisfaisante de la nature discontinue (quantique) des spectres atomiques.
Son modèle prévoit que les électrons gravitent à des rayons fixes autour du proton. Heisenberg démontrera qu’en toute rigueur ceci n’est pas exact. Mais Niels Bohr se méfiait de toute vérité par trop omnisciente et les limitations de son propre modèle n’ont pas dû l’affecter. D’ailleurs il s’est toujours interrogé sur la nature des vérités qu’il proposait, comme de celles qu’on lui proposait. En hommage à Edgar A. En 1913, Niels Bohr découvrait la structure de l'atome. Quand on pense à un atome, on a l'image d'un système solaire en miniature, avec un noyau au centre et les électrons qui tournent autour sur des orbites circulaires.
Ce schéma a eu un tel succès qu'on nomme "orbitaux électroniques" les états occupés par le cortège d'électrons. Or ce modèle, tout en étant inadéquat - les électrons, notamment, ne tournent pas en rond comme des petites billes bien sages -, a été un passage privilégié vers la compréhension de l'atome. Cette histoire commence en 1911, quand Niels Bohr, âgé de 26 ans laisse le Danemark pour le Royaume-Uni. C'est en contrat postdoctoral à Manchester, dans le groupe de Rutherford, que Bohr s'épanouira. Rutherford vient d'étudier la diffusion des particules sur une mince feuille d'or. Bohr commence alors à étudier un autre modèle,...