

Configuración electrónica. Recuerda que el número atómico de un elemento es el número de protones que hay en su núcleo.
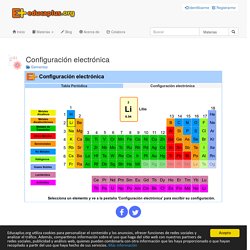
Por ejemplo, el número atómico del magnesio es 12 es decir, que en el núcleo de un átomo de magnesio hay 12 protones. Un átomo neutro tiene el mismo número de electrones y protones. ¿Cuántos electrones hay en un átomo neutro de magnesio? Actividad 1 Selecciona el hidrógeno en la tabla. 1.- Basándote en su número atómico, ¿cuántos electrones tiene un átomo de hidrógeno neutro? LAS REACCIONES QUÍMICAS.
La materia puede sufrir cambios mediante diversos procesos.

No obstante, todos esos cambios se pueden agrupar en dos tipos: cambios físicos y cambios químicos. En estos cambios no se producen modificaciones en la naturaleza de las sustancia o sustancias que intervienen. Químicas: Los Orbitales Atómicos. Según el Modelo Atómico de Schrödinger los electrones son ondas de materia que se distribuyen en el espacio según la función de ondas (Ψ): (δ2Ψ/δx2) + (δ2Ψ/δy2) + (δ2Ψ/δz2) + (8π2m/h2)(E-V)Ψ = 0 De esta manera, los electrones se distribuyen por el espacio en orbitales que son las regiones con una alta probabilidad de encontrarlos.
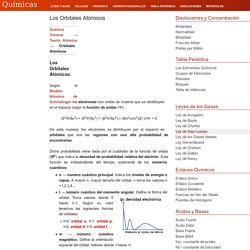
Dicha probabilidad viene dada por el cuadrado de la función de ondas (Ψ2) que indica la densidad de probabilidad relativa del electrón. Ciencias III. El mol y cómo contamos las moléculas. Numero de avogadro y mol. En las experiencias ordinarias de laboratorio el químico no utiliza cantidades de sustancia del orden del átomo o de la molécula, sino otras muy superiores, del orden de gramos normalmente.

Es, pues, mucho más útil introducir un nuevo concepto: una unidad que, siendo múltiplo de la masa de un átomo o de una molécula, represente cantidades de materia que sean ya manejables en un laboratorio. ¿Qué es el Mol? - Súper Didáctico. Leyes ponderales de la Química – Lidia con la Química. Para los químicos del siglo XVIII, un compuesto era una sustancia formada por dos o más elementos y que podía ser separada en estos elementos utilizando los procedimientos químicos adecuados.
Se sabía que al suministrar calor a un metal en el aire se obtenía el óxido correspondiente (síntesis) y algunas sustancias se descomponían en sus elementos (análisis). Número atómico, masa atómica e isótopos (artículo) Masa atómica y masa molecular, relativas y absolutas., Estequiometría: Fórmula empírica y molecular. Rubén Darío Osorio GiraldoFacultad de Ciencias Exactas y NaturalesUniversidad de Antioquia La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula.

También puede darnos información adicional como la manera en que se unen dichos átomos mediante enlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura o formulación química. La formula química permite determinar la composición porcentual de cada elemento en una sustancia compuesta. QUIMICA - ATOMO, , PROTONES, ELECTRONES Y NEUTRONES - Parte 1. Química: Teoría Atómica 9: Modelo Mecánico Cuántico. Fuerzas intermoleculares. 1.- ¿Qué son las fuerzas intermoleculares?
Las fuerzas o uniones intermoleculares son aquellas interacciones que mantienen unidas las moléculas. Tipos de nomenclatura quimica - Quimica. En nomenclatura quimica, el conjunto de reglas pre-establecidas internacionalmente y que debieran asignar nombres unívocos a las sustancias, es decir un solo nombre para una sustancia y una sola sustancia para un nombre.
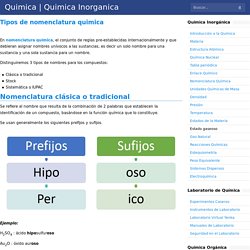
Distinguiremos 3 tipos de nombres para los compuestos: Clásica o tradicional Stock Sistemática o IUPAC Nomenclatura clásica o tradicional. Corrosión de metales. Se denomina corrosión al proceso de destrucción de los metales y sus aleaciones, provocado por la acción química o electroquímica.
La corrosión causa un enorme daño a la economía de los países. USOS Y APLICACIONES. DE ÓXIDOS Y PERÓXIDOS-QUIMICA. LDA: Uniones qcas. Cohete casero de vinagre y bicarbonato de sodio │ Experimento Fácil. ¿QUÉ UNA DISOLUCIÓN? ¿CUÁLES SON LOS TIPOS DE DISOLUCIÓN? TIPOS DE DISOLUCIONES EA) Laboratorio de Química Enlace Químico. Un cohete casero y sin fuego. A muchísimas personas les encantan los fuegos artificiales, los cohetes y las cosas que salen desprendidas por los aires.
Lamentablemente, muchas veces estas aparatosas reacciones son muy peligrosas y no se puede experimentar sin equipo y espacios especiales para ello. Afortunadamente, existen algunos experimentos que nos permiten lanzar objetos por los aires de forma prácticamente a prueba de accidentes. Preparar un cohete casero es muy sencillo y divertido, además de que se puede aprovechar para explicar muchos fenómenos de los gases. Esto es conveniente por varios motivos: en primera, porque los gases son las sustancias “relativamente” más sencillas de estudiar, así que siempre se utilizan para introducir a los interesados en el mundo de la química. En segundo lugar, sirve para quitar la inquietud de muchas personas sobre lanzar cosas al techo sin peligro alguno.
Materiales Cómo proceder Este experimento requiere menos de 10 minutos de preparación. Estamos listos para empezar. Química: Orbitales Atómicos. 5. Qué son los números cuánticos - Química. La partícula de Dios y el tamaño real del átomo. Química: Introducción a la Tabla Periódica. Química: Configuración Electrónica. Química y Física: Primeros modelos de átomo (Dalton,Thomson,Rutherford, y Bohr) 08 Rutherford y el núcleo del átomo. Experimento de J.J. Thomson. 3q7 3. La historia del átomo.
Historia de la tabla periódica. Los seres humanos siempre hemos estado tentados a encontrar una explicación a la complejidad de la materia que nos rodea. Al principio se pensaba que los elementos de toda materia se resumían al agua, tierra, fuego y aire. Sin embargo al cabo del tiempo y gracias a la mejora de las técnicas de experimentación física y química, nos dimos cuenta de que la materia es en realidad más compleja de lo que parece. Los químicos del siglo XIX encontraron entonces la necesidad de ordenar los nuevos elementos descubiertos.
La primera manera, la más natural, fue la de clasificarlos por masas atómicas, pero esta clasificación no reflejaba las diferencias y similitudes entre los elementos. Muchas más clasificaciones fueron adoptadas antes de llegar a la tabla periódica que es utilizada en nuestros días. Döbereiner Este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades en 1817. Químicas: El Modelo Atómico de Dalton.