

L'ISO 13485:2016 à l'heure du règlement (UE) 2017/745. Le nouveau règlement relatif au dispositifs médicaux rebat les cartes en matière d’obligation pour les fabricants; considérablement plus détaillé que la directive 93/42 il impacte directement les systèmes qualité des fabricants, pour la plupart conformes à l’EN ISO 13485:2016.
Cet article fait le point sur l’utilisation de la 13485 dans ce nouveau contexte, en mettant en avant les exigences couvertes et les efforts à fournir pour ce mettre à niveau. Notez qu’un guide sera publié sous peu, l’ISO TR 17223 : une super annexe Z pour les règlements DM (2017/745) et DM-DIV (217/746). Les exigences en matière de SMQ sont relativement modestes dans le règlement, à peine 5% de l’ensemble des exigences applicables aux fabricants. ISO survey 2016 : les certificats 13485 et 9001. Comme chaque année, l’ISO publie son rapport sur la certification des systèmes de management, avec des chiffres par pays et zones géographiques.
L’occasion de regarder les évolution pour la 13485 (qui vient de passer en version 2016) et pour la 9001 (et sa version 2015) Le rapport 2016 de l’ISO (sur l’année 2015) est disponible ici. Ci-dessous un visuel avec : les nombres de certificats 9001 et 13485 en 2015les évolutions 2013/2014 et 2014/2015 Un processus « Mesure et Analyse » douteux côté ISO. ISO 13485:2016 - les coquilles de la version NF. La norme NF EN ISO 13485:2016 est sortie en avril dernier, avec son lot de coquilles.
Un correctif est prévu, mais les délais sont loooong. Cet article liste les erreurs déjà repérées, certaines sont potentiellement lourdes de conséquences. Le but de ce billet est de limiter la casse en attendant un prochain tirage. N’hésitez pas à contribuer, en comparant la version française et anglaise (mais tout le monde n’achete pas les deux normes …), cela sera remonté à la commission de normalisation. Qualitiso devient membre de la commission Afnor S95B. Le titre est pompeux, en fait Qualitiso est une entreprise individuelle, j’ai donc le plaisir de vous annoncer que je suis membre de la commission afnor S95B: « Management de la qualité et aspects généraux correspondants des dispositifs médicaux« .
La classe. Vous trouverez des détails sur les activités de la commission dans la suite de l’article, sachez qu’elle travaille sur des normes capitales pour l’industrie du DM: ISO 13485 et ISO 14971 sont de bons exemples. Ces normes vous concernent directement, je vous invite à me remonter toute interrogation / suggestion autour des travaux de la commission, dont je vous tiendrai régulièrement informés. L’Afnor a créé une page autour de la commission S95B, vous y trouverez la liste des membres ainsi que le programme de travail (normes à l’étude, normes en cours de validation et normes publiées depuis 1 an). La commission S95B est le « miroir » Français du comité technique international ISO TC210 les normes concernées sont listée sur cette page.
Une double certification ISO 9001:2015 et ISO 13485:2016 toujours possible ? Le petit monde du management de la qualité est en pleine ébullition: une nouvelle révision de l’ISO9001 a été publiée en septembre 2015, l’ISO 13485 passera en version 2016 d’ici quelques mois.
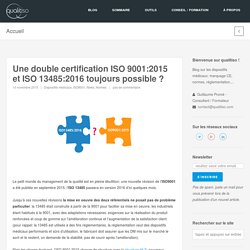
Jusqu’à ces nouvelles révisions la mise en oeuvre des deux référentiels ne posait pas de problème particulier: la 13485 était construite à partir de la 9001 pour faciliter sa mise en oeuvre, les industriels étant habitués à la 9001, avec des adaptations nécessaires: exigences sur la réalisation du produit renforcées et coup de gomme sur l’amélioration continue et l’augmentation de la satisfaction client (pour rappel: la 13485 est utilisée à des fins réglementaires, la réglementation veut des dispositifs médicaux performants et sûrs d’utilisation, le fabricant doit assurer que les DM mis sur le marché le sont et le restent, on demande de la stabilité, pas de courir après l’amélioration). La réponse est oui, de toute façon vous n’avez pas le choix. Nombre de certificats ISO 9001 et 13485: nouvelle étude ISO.
ISO 9001:2015 - comparaison avec la version 2008. La norme ISO 9001:2015 évolue par rapport à sa précédente révision de 2008, l’adoption d’une nouvelle structure, la structure HLS, est révélatrice de changements profonds.
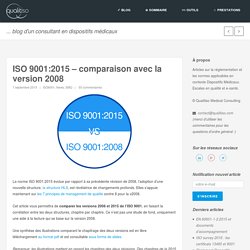
Elles s’appuie maintenant sur les 7 principes de management de qualité contre 8 pour la v2008. Cet article vous permettra de comparer les versions 2008 et 2015 de l’ISO 9001, en faisant la corrélation entre les deux structures, chapitre par chapitre. Ce n’est pas une étude de fond, uniquement une aide à la lecture qui se base sur la version 2008. Une synthèse des illustrations comparant le chapitrage des deux versions est en libre téléchargement au format pdf et est consultable sous forme de slides. Remarque: les illustrations mettent en regard les chapitres des deux révisions. Le domaine d’application est inchangé, dans le texte l’expression « produit » est étendue aux « produits et services », ce qui était déjà implicite. Vérifier et Valider au sens des normes (ISO9001, 13485,...) - Qualitiso - dispositifs médicaux.
C’est une des questions que l’on se pose lorsque l’on s’intéresse aux exigences normatives: “Qu’elles sont les différences entre Vérifier et Valider ?”.
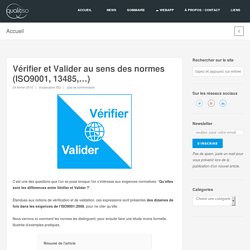
Étendues aux notions de vérification et de validation, ces expressions sont présentes des dizaines de fois dans les exigences de l’ISO9001:2008, pour ne citer qu’elle. Nous verrons ici comment les normes les distinguent, pour ensuite faire une étude moins formelle, illustrée d’exemples pratiques. Comment définir Vérifier et Valider ? Vérifier consiste à s’assurer que les choses font faites conformément à ce qui avait été définiValider consiste à s’assurer que les résultat est bien atteint Vérification et validation peuvent-elles être réalisées par la même personne ? Y a t-il un chronologie à respecter ? La vérification est réalisée avant la validation.Tout changement peut induire la nécessité d’effectuer de nouvelles vérifications et validations.
La vérification va comparer le résultats d’une activité avec ce qui était initialement prévu. Élaboration d'une norme ISO: étapes et documents publiés. Le processus d’élaboration d’une norme international est détaillé dans le §2 du document Directives ISO/CEI Partie 1.
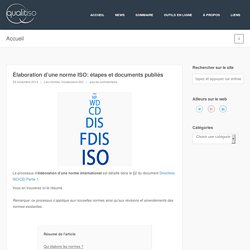
Vous en trouverez ici le résumé. Remarque: ce processus s’applique aux nouvelles normes ainsi qu’aux révisions et amendements des normes existantes. Qui élabore les normes ? Des comités techniques internationaux, qui ont des comités miroirs, notamment en Europe et en France. Les 7 principes de management de la qualité. HLS: La structure universelle des normes de management. La structure HLS (High Level Structure) propose un cadre commun pour les normes relatives aux systèmes de management.
Certaines sont déjà alignées sur la HLS, comme l’ISO 27001 (management de la sécurité des informations) d’autre le seront dès leur prochaine édition, comme les très attendues ISO 14001 (management environnemental) et ISO 9001:2015 (management de la qualité). Cet article propose de résumer la structure HSL, en s’appuyant sur l’annexe SL / appendice 2 des Directives ISO/CEI, Partie 1 – Supplément ISO consolidé – Procédures spécifiques à l’ISO, sur les DIS de 2014 des normes ISO 14001 et ISO 9000 (management de la qualité – Principes essentiels et vocabulaire) et sur le FDIS de l’ISO 9001:2015. Remarque: comme expliqué dans l’article sur la signification des abréviations dans les noms des normes, DIS signifie Draft International Standard (projet de norme internationale), FDIS signifie Final Draft International Standard. Signification des Titres de Norme. Vous l’avez sans doute constaté lors de vos recherches de normes sur un site comme celui de l’afnor: les titres des normes sont assez difficiles à appréhender, pour qui n’a pas l’habitude.
Vous trouverez dans cet article les définitions des principaux termes employés, d’autres articles compléteront ces informations en expliquant les subtilités de ces informations. Toutes ces informations seront complétées au fil du temps, n’hésitez pas à soumettre un nouveau point que vous auriez rencontré. 4 principaux groupes d’informations peuvent être déduits de la lecture du titre d’une norme / d’un document. Ils apparaissent généralement dans cet ordre: Le type documentLa zone géographique concernée par le documentL’organisme à l’origine de la rédactionL’étape courante dans le cycle de rédaction Cette liste est loin d’être exhaustive, néanmoins vous y trouverez les organismes l’on rencontre le plus souvent. Tous les documents ne sont pas des normes, on trouve également: Normes Françaises d'application obligatoire. Qu’est ce qu’une norme d’application obligatoire ?
A l’échelle de la France: c’est une norme dont le recours est imposé par un texte réglementaire. Quels sont les secteurs concernés ? En caricaturant: les secteurs suffisamment importants et critiques pour que la décision de légiférer ait été prise. Peut on consulter gratuitement ces normes ? Oui, sur le site de l’Afnor, mais de façon limitée (tant sur le nombre de normes disponibles que sur les moyens de consultation). Lorsque cela est jugé nécessaire la France peut rendre obligatoire le recours à une norme comme unique moyen de mise en conformité avec une exigence. “AFNOR n’assume aucune responsabilité en raison de l’éventuelle inexactitude ou imprécision des informations fournies dans le présent document, l’utilisation de ces informations se faisant aux risques de l’utilisateur” Précautions légitimes tant il est difficile de faire le tour de tous les textes réglementaire.
Ce système impose des limites: