

Tableau périodique des éléments. Un article de Wikipédia, l'encyclopédie libre.
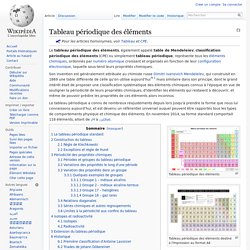
Le tableau périodique des éléments, également appelé table de Mendeleïev, classification périodique des éléments (CPE) ou simplement tableau périodique, représente tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leur configuration électronique, laquelle sous-tend leurs propriétés chimiques. Son invention est généralement attribuée au chimiste russe Dimitri Ivanovich Mendeleïev, qui construisit en 1869 une table différente de celle qu'on utilise aujourd'hui[N 1] mais similaire dans son principe, dont le grand intérêt était de proposer une classification systématique des éléments chimiques connus à l'époque en vue de souligner la périodicité de leurs propriétés chimiques, d'identifier les éléments qui restaient à découvrir, et même de pouvoir prédire les propriétés de ces éléments alors inconnus.
Tableau périodique des éléments. Pendant l'Antiquité, on considérait les éléments différemment : les corps étaient classés en solides, liquides et vapeurs et selon leur couleur, et leur interaction suivant des notions de sympathie et d'antipathie.
Cette philosophie reposait sur la théorie des quatre éléments (le feu, l’eau, la terre et l’air) d'Aristote reprise par Platon. (Voir l'histoire de la chimie).Origine des éléments (Suivre le lien), à noter que les tout premiers éléments formés naturellement (Big Bang) se retrouvent en haut du tableau (ligne 1 : hydrogène et hélium), et les éléments synthétisés par l'homme (éléments synthétiques), sont en bas du tableau (voir le tableau ci-dessous).Les éléments chimiques sont une catégorie d'atomes ayants en commun le même nombre de protons dans leur noyau atomique. Un atome est un assemblage de protons, de charge positive, et de neutrons, de charge nulle, le tout entouré d'électrons de charge électrique négative. Les atomes peuvent se combiner de façons très variables. Version étendue du tableau périodique des éléments.
Un article de Wikipédia, l'encyclopédie libre.
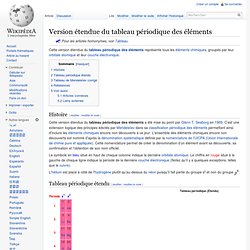
Pour les articles homonymes, voir Tableau. Cette version étendue du tableau périodique des éléments représente tous les éléments chimiques, groupés par leur orbitale atomique et leur couche électronique. Histoire[modifier | modifier le code] Cette version étendue du tableau périodique des éléments a été mise au point par Glenn T. Seaborg en 1969. Le symbole en bleu situé en haut de chaque colonne indique la dernière orbitale atomique. L'hélium est placé à côté de l'hydrogène plutôt qu'au-dessus du néon puisqu'il fait partie du groupe s² et non du groupe.
Élément chimique. Série chimique. Métaux. Un article de Wikipédia, l'encyclopédie libre.
Les métaux sont une classe de matériaux très utilisés dans de nombreux domaines : construction (charpentes métalliques, menuiserie en aluminium), plomberie (tuyaux, robinets), véhicules (du vélo à l'avion), machines industrielles, armement,… Les métaux sont également de plus en plus employés dans la plupart des techniques de pointe : accumulateurs électriques, cartes électroniques, écrans plats LCD, capteurs solaires photovoltaïques, lampes fluo-compactes, diodes électroluminescentes,… La consommation des métaux s'est ainsi très fortement accrue depuis les années 1980, au point que certains métaux rares sont devenus des matières premières minérales critiques.
Métal chauffé par un forgeron Généralités[modifier | modifier le code] Les métaux ont en commun certaines propriétés comme notamment Dans la classification périodique, les métaux sont au centre et à gauche.
Métaux alcalin. Métaux alcalino-terreux. Métaux de transition. Lanthanides. Actinides. Métaux pauvres. Terres rares. Non métaux. Métalloïdes. Halogènes. Gaz nobles. Éléments de la période 8. Les transactinides. Un article de Wikipédia, l'encyclopédie libre.
On qualifie de transactinide tout élément chimique dont le numéro atomique est supérieur à celui du lawrencium (no 103), le dernier des actinides[1]. Les transactinides sont également appelés éléments superlourds. Ce sont, par définition, également des transuraniens, ayant un numéro atomique supérieur à celui de l'uranium (no 92). Parmi les transuraniens, les transactinides présentent certaines particularités : Aucun transactinide n'existe a l'état naturel, tous sont des éléments synthétiques radioactifs qui doivent être produits en laboratoire pour être observés.
Les transuraniens. Îlot de stabilité. Un article de Wikipédia, l'encyclopédie libre.
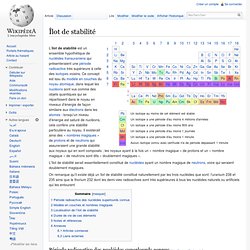
L'îlot de stabilité serait essentiellement constitué de nucléides ayant un nombre magique de neutrons, voire qui seraient doublement magiques. On remarque qu'il existe déjà un îlot de stabilité constitué naturellement par les trois nucléides que sont: l'uranium 238 et 235 ainsi que le thorium 232 dont les demi-vies radioactives sont très supérieures à tous les nucléides naturels ou artificiels qui les entourent Période radioactive des nucléides superlourds connus[modifier | modifier le code] Tous les transuraniens sont radioactifs, et les nucléides les plus lourds actuellement connus présentent, au-delà de Z = 107 (bohrium-270), une période radioactive inférieure à 10 secondes : La découverte de noyaux encore plus lourds ayant des périodes radioactives plus longues constituerait par conséquent un pas important dans la compréhension de la structure du noyau atomique.
Modèle en couches et nombres magiques[modifier | modifier le code] Les superactinides. Un article de Wikipédia, l'encyclopédie libre.
On appelle superactinide tout élément chimique — dont l'existence demeure à ce jour hypothétique — de numéro atomique compris entre 121[1] (unbiunium) et 153 (unpenttrium). Ces éléments feraient suite aux transactinides, remplissant progressivement les sous-couches 5g et 6f par numéro atomique croissant. L'existence de cette série avait été conjecturée par Glenn Seaborg, lauréat du Prix Nobel de chimie 1951[2].