Comparatif Formats et Technologies
Comment choisir la pile qu'il vous faut ?La question revient souvent sans forcément avoir de réponse précise. Piles & Plus vous apporte donc des précisions pour faire le bon choix de piles. 1 - Bien choisir avec les notions et le lexique Alcaline : Technologie d’une pile standard, non rechargeable, version plus élaborée que la saline. 2 - Comparatifs produits : piles Certains éléments sont à prendre en compte pour choisir une pile: Le format de la pile doit correspondre à celui requis par l'utilisation ou l'appareil électrique.La technologie de la pile doit aussi être adéquate avec l'utilisation voulue. Les technologies des piles sont différentes c'est pourquoi Piles & Plus vous explique clairement les particularités de chacune : Lithium (Energizer Ultimate Litium): Spécialement conçue pour les appareils de haute technologie. Quelle technologie de pile pour quel appareil électrique ? Comment optimiser l'usage de vos piles ? 3 - Questions fréquentes
theobromine's blog » Labo : La vérité sur la pile citron ;-)
nov 16 2007 (26/10/2008) Une petite mise à jour : Un coffret « Drôles de piles » La pile citron est un grand classique de l’activité scientifique. Quel bonheur de constater qu’un citron est capable de remplacer une pile bouton et d’alimenter en énergie une carte musicale. Disons tout de suite que le citron c’est bien mais une orange, une pomme de terre ou tout simplement une solution saline peuvent jouer le même rôle avec plus ou moins d’efficacité. Les sciences appliquées du CESU ont testé pour vous la pile citron et la pile patate et ont tenté de distinguer le rôle des constituants. Il s’agit (bien évidemment) d’une réaction d’oxydo-réduction entre les couples Zn/Zn++ (une des électrodes) et H2/H+ (solution acide du citron). Cette hypothèse étant formulée nous avons tenté de la vérifier, de la compléter en modifiant certains paramètres ou en cherchant des informations sur le net. S’agit-il d’une pile style Daniell (Cu/Zn) dans laquelle l’électrolyte serait remplacé par le jus du citron ?
Pourquoi le nom "Piles" ?
Concrètement, la pile est composée de deux électrodes - un pôle positif (ou cathode) et un pôle négatif (ou anode) - plongées dans une solution saline ou alcaline faisant office de conducteur. Lorsque ces électrodes sont reliées par un fil conducteur à un consommateur électrique, une ampoule par exemple, cela ferme le circuit. Il se crée alors un courant d'électrons ou courant électrique qui circule à travers le conducteur d'un pôle à l'autre de la pile. Le fonctionnement d'une pile permet ainsi d'utiliser l'énergie d'une réaction chimique. 1789 : Luigi Galvani découvre l'électrochimie A la fin du 18e siècle, le médecin et physicien italien Luigi Galvani, constate que les muscles d'une cuisse de grenouille se contractent lorsqu'elle est mise en contact avec des métaux. 1800 : Allessandro Volta crée la première pile À partir des travaux de Galvani, Alessandro Volta crée près de dix années plus tard, la première pile à colonne. 1886 : Georges Leclanché invente la pile moderne
La batterie du futur compte sur la pomme de terre > Technologie
La société Yissum Research Ltd, qui est en quelque sorte le bras technologique de l'Université hébraïque de Jérusalem, annonce avoir développé une nouvelle batterie solide organique qui fonctionne avec des pommes de terre spécialement traitées. Simple, durable et solide, le dispositif pourrait potentiellement apporter une solution immédiate et peu coûteuse aux besoins en électricité des populations situées dans les régions rurales les plus reculées. Des chercheurs de l'Université Hébraïque ont en effet découvert qu'une capacité accrue de sel dans les tubercules de pomme de terre avait pour effet de produire davantage d'électricité. Bon marché (zinc et électrodes de cuivre) et facile à concevoir, cette source d'énergie verte pourrait améliorer considérablement la qualité de vie de 1,6 milliard de personnes. Elle pourrait ainsi contribuer à satisfaire des besoins importants de ces populations dans des domaines, tels que l'éclairage, la télécommunication, ou encore l'accès à l'information.
Piles et accumulateurs
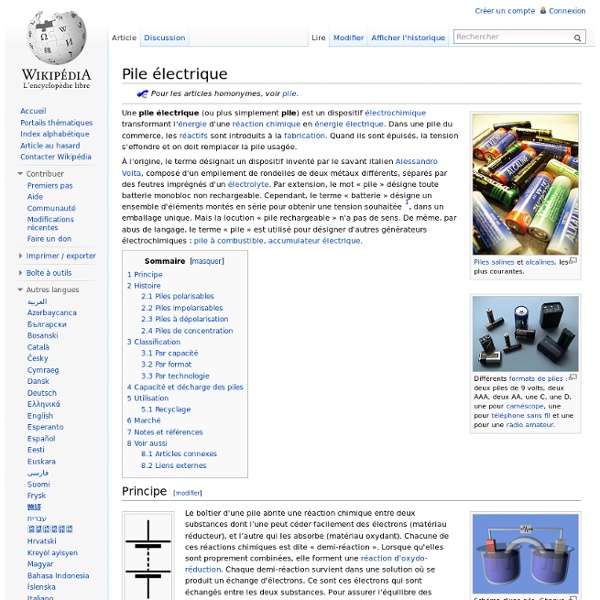
Les piles alcalines Aujourd'hui très répandues, les piles alcalines sont sensiblement plus performantes que les piles salines. Elles sont bien adaptées à la plupart des équipements électriques autonomes. De plus, ces piles peuvent être stockées beaucoup plus longtemps. Les piles au lithium Apparues plus récemment dans le commerce, les piles au lithium sont destinées: aux applications nécessitant une capacité élevée, une taille ou une masse réduite (à taille identique, les piles au lithium sont jusqu’à 30 % plus légères que les piles alcalines) une plage de température de fonctionnement étendue. Les lampes frontales Petzl sont équipées d’origine avec des piles de types:- alcalines bâton (1,5 V)- lithium bouton (3 V) Les piles produisent un courant électrique continu par transformation de l’énergie chimique en énergie électrique. Montage et polarités Quels que soient le type et le format, les piles sont toujours polarisées (un pôle + et un pôle -). Energie Durée Pile alcaline (bâton) Energie
Corrosion et protection des métaux en milieu marin
La corrosion est une interaction entre un matériau métallique et son environnement qui entraîne une dégradation du matériau, c'est-à-dire des modifications de ses propriétés susceptibles de conduire à un dysfonctionnement du système technique auquel il participe (norme NF EN ISO 8044). Aux températures ambiantes, le phénomène résulte le plus souvent de l'action combinée d'un milieu aqueux et du dioxygène de l'air. Il est donc clair, et de ce fait doit toujours rester présent à l'esprit, que la résistance à la corrosion d'un métal n'est pas une propriété intrinsèque, au même titre que la masse volumique par exemple, mais dépend d'un grand nombre de paramètres, dont ceux liés au milieu agressif. La corrosion « aqueuse » est de nature électrochimique et ne peut se comprendre sans les connaissances de base de cette discipline. Nous ferons ici l'hypothèse que le lecteur possède ces bases, qui sont par ailleurs aisément accessibles
Corrosion aqueuse
Un article de Wikipédia, l'encyclopédie libre. Corrosion généralisée : la dissolution des métaux[modifier | modifier le code] La corrosion des métaux consiste essentiellement en leur oxydation, qui est un « retour à l'état naturel. » Cependant, l'oxydation n'est pas nécessairement la combinaison d'un élément avec de l'oxygène. D'une manière plus générale, il s'agit d'une réaction chimique au cours de laquelle un composé considéré cède des électrons. Par exemple, le fer s'oxyde en présence du dioxygène de l'air pour former de l'hématite (Fe203) : peut s'écrire L'hématite peut donc être décrite comme un cristal ionique (Fe3+2, O2-3), ce qui n'est pas tout à fait exact, mais donne une bonne approche du phénomène d'oxydation. La corrosion des métaux en milieu aqueux résulte de l'oxydation du métal, mais pas nécessairement par le dioxygène de l'air qui est dissous dans l'eau : l'oxydation peut également se produire avec d'autres espèces chimiques, notamment des ions. L'intensité est fonction de :