


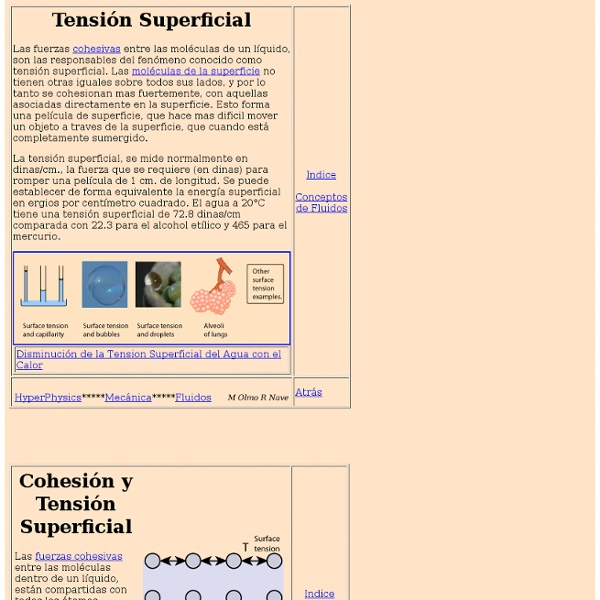
TENSIÓN SUPERFICIAL Las moléculas de un líquido se atraen entre sí, de ahí que el líquido esté "cohesionado". Cuando hay una superficie, las moléculas que están justo debajo de la superficie sienten fuerzas hacia los lados, horizontalmente, y hacia abajo, pero no hacia arriba, porque no hay moléculas encima de la superficie. El resultado es que las moléculas que se encuentran en la superficie son atraídas hacia el interior de éste. La tensión superficial se define en general como la fuerza que hace la superficie (la "goma" que se menciona antes") dividida por la longitud del borde de esa superficie (OJO: no es fuerza dividida por el área de la superficie, sino dividida por la longitud del perímetro de esa superficie). donde F es la fuerza que debe hacerse para "sujetar" una superficie de ancho l. Algunos valores de la tensión superficial son: La siguiente figura muestra un ejemplo de cómo algunos animales utilizan la tensión superficial del agua. Regresar
Tensión superficial Ejemplo de tensión superficial: una aguja de acero sobre un líquido. En física se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área.[1] Esta definición implica que el líquido tiene una resistencia para aumentar su superficie. Este efecto permite a algunos insectos, como el zapatero (Gerris lacustris), desplazarse por la superficie del agua sin hundirse. La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad. Como efecto tiene la elevación o depresión de la superficie de un líquido en la zona de contacto con un sólido. Otra posible definición de tensión superficial: es la fuerza que actúa tangencialmente por unidad de longitud en el borde de una superficie libre de un líquido en equilibrio y que tiende a contraer dicha superficie. Causa[editar]
Capilaridad La capilaridad es un proceso de los fluidos que depende de su tensión superficial la cual, a su vez, depende de la cohesión del líquido y que le confiere la capacidad de subir o bajar por un tubo capilar. Cuando un líquido sube por un tubo capilar, es debido a que la fuerza intermolecular o cohesión intermolecular entre sus moléculas es menor que la adhesión del líquido con el material del tubo; es decir, es un líquido que moja. El líquido sigue subiendo hasta que la tensión superficial es equilibrada por el peso del líquido que llena el tubo. Éste es el caso del agua, y esta propiedad es la que regula parcialmente su ascenso dentro de las plantas, sin gastar energía para vencer la gravedad. Tubo capilar[editar] Efectos de capilaridad. Dos placas de vidrio que están separadas por una película de agua de 1 µm de espesor, se mantienen unidas por una presión de succión de 1,5 atm. Ley de Jurin[editar] donde: θ = ángulo de contacto ρ = densidad del líquido (kg/m³) r = radio del tubo (m) θ = 0°
Física/Fenómenos superficiales de los líquidos/Tensión superficial De Wikilibros, la colección de libros de texto de contenido libre. Ejemplo de tensión superficial: una aguja de acero flotando en agua. Diagrama de fuerzas entre dos moléculas de un líquido En física se denomina tensión superficial al fenómeno por el cual la superficie de un líquido tiende a comportarse como si fuera una delgada película elástica. Este efecto permite a algunos insectos, como el zapatero (Hydrometra stagnorum) , desplazarse por la superficie del agua sin hundirse. La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad, por ejemplo. A nivel microscópico, la tensión superficial se debe a que las fuerzas que afectan a cada molécula son diferentes en el interior del líquido y en la superficie. Propiedades[editar] La tensión superficial suele representarse mediante la letra γ. Algunas propiedades de γ:
Tensión superficial en los líquidos En un fluido cada molécula interacciona con las que le rodean. El radio de acción de las fuerzas moleculares es relativamente pequeño, abarca a las moléculas vecinas más cercanas. Vamos a determinar de forma cualitativa, la resultante de las fuerzas de interacción sobre una molécula que se encuentra en A, el interior del líquido B, en las proximidades de la superficie C, en la superficie Consideremos una molécula (en color rojo) en el seno de un líquido en equilibrio, alejada de la superficie libre tal como la A. En cambio, si la molécula se encuentra en B, por existir en valor medio menos moléculas arriba que abajo, la molécula en cuestión estará sometida a una fuerza resultante dirigida hacia el interior del líquido. Si la molécula se encuentra en C, la resultante de las fuerzas de interacción es mayor que en el caso B. Coeficiente de tensión superficial La fuerza F es independiente de la longitud x de la lámina. Si llamamos a g la energía por unidad de área, se verificará que ΔF=2·γ(a+c)
Tensión superficial Tensión superficial es la fuerza en la superficie normal a una línea de longitud unitaria dibujada en la superficie del líquido Su manifestación es un efecto de "malla superficial" o membrana elástica que rodea la masa fluida Pompa penetrada por gotas que impactan Corresponde a una combinación de fuerzas de atracción entre las partículas, su naturaleza es posiblemente de tipo eléctrico, y por este motivo su valor es más alto en líquidos que en gases. La cohesión es la fuerza de atracción intermolecular de partículas de la misma naturaleza. La adhesión es la fuerza de atracción intermolecular entre partículas de diferente naturaleza. Si la adhesión es mayor que la cohesión el fluido es humectante (agua-vidrio) Si la adhesión es menor que la cohesión el fluido es no humectante (mercurio-vidrio, agua-superficie grasosa)) Tensión superficial del agua Observe que la tensión superficial del agua a 20 °C es 0,0736 N/m ¿Cómo se comporta la tensión superficial del agua con el aumento de la temperatura?
Archivo:WassermoleküleInTröpfchen.svg Cancel Edit Delete Preview revert Text of the note (may include Wiki markup) Could not save your note (edit conflict or other problem). Upon submitting the note will be published multi-licensed under the terms of the CC-BY-SA-3.0 license and of the GFDL, versions 1.2, 1.3, or any later version. Add a note Draw a rectangle onto the image above (press the left mouse button, then drag and release). Save To modify annotations, your browser needs to have the XMLHttpRequest object. [[MediaWiki talk:Gadget-ImageAnnotator.js|Adding image note]]$1 [[MediaWiki talk:Gadget-ImageAnnotator.js|Changing image note]]$1 [[MediaWiki talk:Gadget-ImageAnnotator.js|Removing image note]]$1
PROPIEDADES DE LOS FLUIDOS Una molécula en el interior de un líquido está sometida a fuerzas de atracción en todas las direcciones, siendo la resultante de dichas fuerzas igual a cero. Sin embargo, una molécula situada en la superficie de un líquido se ve sometida a una fuerza de cohesión neta perpendicular a la superficie y hacia el interior del fluido. Como se necesita realizar un trabajo para mover una molécula del interior hacia la superficie, en contra de dicha fuerza de cohesión neta, las moléculas superficiales tienen más cantidad de energía mecánica que las moléculas del interior del líquido. Desde el punto de vista energético, se define "tensión superficial" de un líquido como el trabajo que se debe realizar para traer suficientes moléculas desde el interior del fluido hacia la superficie, para formar una nueva unidad de área en dicha superficie. Las dimensiones físicas de la tensión superficial son y sus unidades en el S.I. son N/m. ¿… y qué pasa en la superficie de una gota de agua? ¿… y en una burbuja?