

Les mélanges. Pour faire un mélange, on met ensemble plusieurs sortes d'objets.
On peut obtenir différents résultats. Les objets mélangés sont encore visibles et on peut les séparer assez facilement. Les états de la matière et les changements d'état. On peut se représenter une substance pure, telle que l'eau, comme un ensemble de particules élémentaires trop petites pour être visibles à l'œil nu ou même avec les microscopes optiques les plus puissants.
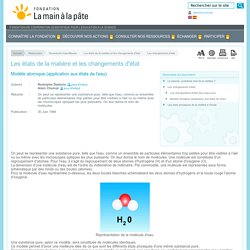
On leur donne le nom de molécules. Une molécule est constituée d'un regroupement d'atomes. Pour l'eau, il s'agit du regroupement de deux atomes d'hydrogène (H) et d'un atome d'oxygène (O). La dimension d'une molécule d'eau est de l'ordre du millionième de millimètre. Par commodité, une molécule est représentée sous forme schématique par des ronds ou des boules (atomes). Représentation de la molécule d'eau. Les états de la matière et les changements d'état. Les corps purs peuvent exister sous différents états (solide, liquide et gazeux) selon les conditions de température et de pression.
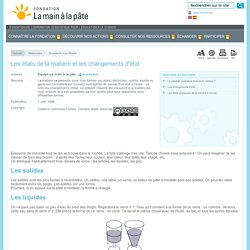
Lorsque la matière passe d’un état à un autre état, on dit qu’il y a changement d’état. Passage solide-liquide : fusion Si le solide est un corps pur (exemple la glace), lorsqu’il passe à l’état liquide, on parle de fusion franche ou plus simplement de fusion. La caractéristique de la fusion d’un corps pur est qu’elle se produit à une température donnée qui reste constante durant toute la durée du changement d’état. Ainsi si on met des glaçons dans un verre qui se trouve lui-même dans une pièce à température ambiante, on constate que le glaçon fond et que la température du verre contenant le glaçon et l’eau reste autour de 0° tant qu’il existe un petit bout de glaçon. Passage liquide-solide : solidification. Les états de la matière et les changements d'état. Une substance peut passer de l'état gazeux à l' état liquide ou solide, de l' état liquide à l'état gazeux ou solide, de l'état solide à l'état gazeux ou liquide ; c'est un changement d'état.
Cela signifie que, suivant les circonstances, un même corps peut se présenter sous forme solide, liquide ou gazeuse. Par exemple, l'eau peut exister sous ces différentes formes qui correspondent à des organisations moléculaires différentes (modèle de la matière). Les états de la matière et les changements d'état. Essayons de nommer tout ce qui se trouve dans le monde.
La liste s'allonge très vite. Tant de choses nous entourent ! Densité et masse volumique. Quelques observations : Un glaçon flotte sur l'eau, un tronc d'arbre flotte sur la rivière.
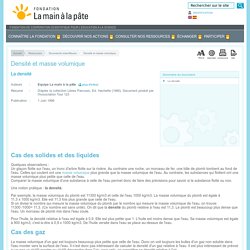
Au contraire une roche, un morceau de fer, une bille de plomb tombent au fond de l'eau. Densité et masse volumique. Une 1re façon de faire : Comparer les masses d'un même volume de substances différentes.
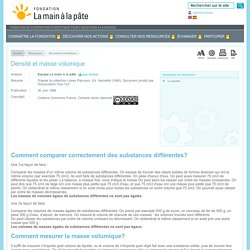
On essaye de trouver des objets solides de formes diverses qui ont le même volume (par exemple 75 cm3). Ils sont faits de substances différentes. On pèse chacun d'eux. On peut aussi mesurer 75 cm3 de différents liquides et les peser. Une 2e façon de faire Comparer les volumes de masses égales de substances différentes. Il suffit de mesurer n'importe quel volume de liquide, ou le volume de n'importe quel objet fait avec une substance solide, puis de trouver leur masse avec une balance.
Les mélanges. 29 notions-clefs : le cycle de l'eau. Introduction.
29 notions-clefs : les états de l'eau. L’eau est très présente sur la Terre.
Elle couvre environ 70 % de sa surface, sous forme d’océans (97,8 %), de rivières et de lacs (0,006 %), de glaces polaires (1,74 %) et de nappes souterraines. On en trouve aussi dans les nuages. Pourtant l’eau est un corps dont le comportement est exceptionnel et elle recèle encore nombre de mystères… Indispensable à la vie, l’eau existe sur notre planète sous trois états différents : solide, liquide, gazeux. 29 notions-clefs : les matériaux. La matière qui nous entoure peut se présenter – suivant la température et/ou la pression – sous trois formes (on dit plutôt états) distinctes: les solides présentent une certaine dureté et conservent en général leur forme (le bois, une pierre, la glace…); les liquides se répandent dans le récipient qui leur est affecté et prennent la forme de celui-ci (l’eau, l’essence, l’huile…); les gaz sont le plus souvent invisibles, impalpables, mais ils se manifestent à nous par leurs effets (l’air, par le vent; le gaz carbonique, par ses bulles dans le champagne…).
Nous savons, au moins dans le cas de l’eau, que la matière est souvent susceptible de passer d’un état à l’autre: la glace, solide, fond à 0°C et devient de l’eau; celle-ci, liquide, bout à 100°C et devient de la vapeur d’eau, qui est un gaz. Dans ces trois formes, il s’agit toujours de la même matière, l’eau. La dureté Les matériaux sont en général perçus comme durs. 29 notions-clefs : matériaux de construction et développement durable.
Avec quoi construisons-nous ? Au-delà des choix individuels, la réponse à cette question est éminemment variée selon la région ou l’époque à laquelle on s’intéresse. Elle varie également selon que l’on s’attache à l’habitat, aux lieux de travail, à la construction industrielle ou aux grands ouvrages. Si les matériaux artificiels dominent actuellement les techniques constructives en Europe, il n’en a pas toujours été ainsi, et il n’en est toujours pas ainsi dans bien des régions du monde. 29 notions-clefs : les couleurs du ciel. Qu’arrive-t-il à la lumière du Soleil ? Un jour clair et ensoleillé, il semble que le Soleil brille de toute sa force. Pourtant, la majeure partie de sa lumière n’atteint jamais le sol. Le rayonnement solaire qui frappe la haute atmosphère est atténué de deux manières : par absorption et par diffusion.
L’absorption est un phénomène dans lequel une partie de la lumière incidente est captée par les molécules qui, par exemple, se mettent à vibrer ou à tourner sur elles-mêmes. Cette énergie interne moléculaire finit par être dissipée en chaleur. L’épaisseur optique Finalement, absorption et diffusion ont le même effet sur la lumière transmise à travers la matière : elles atténuent le faisceau lumineux et le milieu traversé apparaît plus ou moins opaque.
Pourquoi le ciel est-il bleu ? La lumière du Soleil contient toutes les longueurs d’onde, elle est très proche du blanc parfait. Qu’est-ce qui fixe la luminosité du ciel ? Couleur et éclat du Soleil. 29 notions-clefs : les robots. Le premier samedi du monde, dit la Genèse, le Créateur façonna l’Homme. Depuis, ce dernier n’a eu de cesse que de jouer au Créateur… Que ce soit pour tester des connaissances mathématiques, des mécanismes physiques, des principes biologiques ou tout simplement pour se distraire, savants et artistes ont rivalisé au cours des siècles et sur tous les continents pour construire des machines imitant le vivant. Jusqu’au XXe siècle, ces machines n’étaient « que » des automates qui ne disposaient, pour se comporter, que de l’équivalent de nos organes moteurs. Ce type de machine se rencontre encore souvent dans nos usines actuelles : un automate peut peindre parfaitement une voiture, à condition que son concepteur ait très exactement prévu tous ses mouvements, compte tenu de la position de ladite voiture.
29 notions-clefs : le nanomonde. Les nanotechnologies nous promettent monts et merveilles. La synthèse chimique est classique de la démarche bottom-up. Nous savons déjà synthétiser des molécules très compliquées, généralement en solution dans de l’eau ou un autre solvant, grâce à notre connaissance des réactions chimiques, mais nous sommes encore des débutants par rapport à la nature. Le monde vivant est peuplé de molécules très complexes dont certaines – les protéines en particulier – sont de véritables machines (moteurs, pompes, courroies transporteuses) ou usines chimiques.
Cette machinerie moléculaire naturelle constitue une source d’inspiration extraordinairement riche pour les nanotechnologies. Solutions, suspensions et sédimentation. Le frottement des solides. La plasturgie: une métallurgie des matériaux polymères. Un peu d’histoire La métallurgie rend compte de l’ensemble des opérations qui consistent à extraire des minerais, à les purifier, les transformer et les mettre en forme pour leur utilisation finale (en fils, feuilles, lingots…).
Son origine nous ramène à la préhistoire, il y a 10 000 ans. C’est tout naturellement que l’on parle de l’âge du cuivre, du progrès considérable qui marquera l’arrivée de l’âge du bronze, et de l’âge du fer, tout comme on parle de l’âge de pierre (taillée , polie). On devrait peut être parler de l’âge de l’aluminium marqué par les premiers traitements de la bauxite (de l’alumine à l’aluminium) dans la deuxième partie du XIXe siècle.
Serait-il raisonnable de parler de l’âge du plastique aujourd’hui ? Sur le plan scientifique, on peut faire correspondre partiellement les étapes de la métallurgie classique à celles de l’industrie des plastiques. Pourquoi s’intéresser aux propriétés des matériaux. A propos de matières et matériaux : de la science à la technologie. On ne montrera jamais assez aux collégiens combien les progrès de la connaissance sur la matière doivent aux talents du scientifique, du « savant ». Pourquoi s’intéresser aux propriétés des matériaux.