

Aguja. Capilaridad. Capilaridad. La capilaridad es un proceso de los fluidos que depende de su tensión superficial la cual, a su vez, depende de la cohesión del líquido y que le confiere la capacidad de subir o bajar por un tubo capilar.
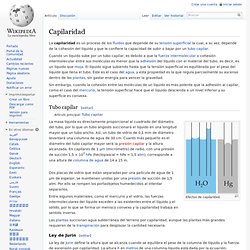
Cuando un líquido sube por un tubo capilar, es debido a que la fuerza intermolecular o cohesión intermolecular entre sus moléculas es menor que la adhesión del líquido con el material del tubo; es decir, es un líquido que moja. El líquido sigue subiendo hasta que la tensión superficial es equilibrada por el peso del líquido que llena el tubo. Éste es el caso del agua, y esta propiedad es la que regula parcialmente su ascenso dentro de las plantas, sin gastar energía para vencer la gravedad. Tubo capilar[editar] Efectos de capilaridad. Dos placas de vidrio que están separadas por una película de agua de 1 µm de espesor, se mantienen unidas por una presión de succión de 1,5 atm.
Ley de Jurin[editar] donde: θ = ángulo de contacto ρ = densidad del líquido (kg/m³) r = radio del tubo (m) θ = 0° Tensioactivos y objetos flotantes. Todos hemos visto algún documental, o incluso con nuestros propios ojos cerca de un río o un lago, un pequeño insecto caminando sobre el agua.

Muchos nos llama la atención este fenómeno, incluso si sois un poco manitas habéis visto que si colocáis una aguja o un clip sobre un vaso de agua con delicadeza este flota en vez de hundirse como esperaríamos. Este fenómeno tiene una explicación y es denominado como tensión superficial. Para explicar dicho efecto tenemos que coger nuestro microscopio imaginario y acercarlo lo máximo que podamos a una molécula de agua del interior de nuestro vaso. Obviamente esta molécula de agua está rodeada de otras moléculas idénticas y está sometida a fuerzas de repulsión-atracción con sus vecinas. Esto provoca que la suma de estas fuerzas sea cero ya que como actúan en múltiples direcciones estas se acaban anulando.
Fuente: Nosotros somos capaces de romper esta tensión superficial del agua con los tensioactivos. Fuente: Fuente:Wikipedia Y todo esto, ¿para qué? TENSIÓN SUPERFICIAL. Las moléculas de un líquido se atraen entre sí, de ahí que el líquido esté "cohesionado".

Cuando hay una superficie, las moléculas que están justo debajo de la superficie sienten fuerzas hacia los lados, horizontalmente, y hacia abajo, pero no hacia arriba, porque no hay moléculas encima de la superficie. El resultado es que las moléculas que se encuentran en la superficie son atraídas hacia el interior de éste. Para algunos efectos, esta película de moléculas superficiales se comporta en forma similar a una membrana elástica tirante (la goma de un globo, por ejemplo). De este modo, es la tensión superficial la que cierra una gota y es capaz de sostenerla contra la gravedad mientras cuelga desde un gotario. Ella explica también la formación de burbujas. donde F es la fuerza que debe hacerse para "sujetar" una superficie de ancho l.
Ejemplos de tensión superficial. La tensión superficial del agua. Vaso de agua y su cohesión entre moleculas.